Il glucagone è un ormone peptidico, prodotto dalle cellule alfa del pancreas. Il glucagone aumenta la concentrazione di glucosio e acidi grassi nel flusso sanguigno ed è considerato il principale ormone catabolico del corpo. Il glucagone è anche utilizzato come farmaco per trattare diverse condizioni di salute. L’effetto del glucagone è opposto a quello dell’insulina, che abbassa il glucosio extracellulari. Il glucagone è prodotto dal proglucagone, codificato dal gene GCG.
Il pancreas rilascia glucagone quando la quantità di glucosio nel flusso sanguigno è troppo bassa. Il glucagone induce il fegato a impegnarsi nella glicogenolisi: convertendo il glicogeno immagazzinato in glucosio, che viene rilasciato nel flusso sanguigno. Al contrario, elevati livelli di glucosio nel sangue stimolano il rilascio di insulina. L’insulina consente al glucosio di essere assorbito e utilizzato dai tessuti dipendenti dall’insulina. Pertanto, glucagone e insulina fanno parte di un sistema di feedback che mantiene stabili i livelli di glucosio nel sangue. Il glucagone aumenta il dispendio energetico ed è elevato in condizioni di stress. Il glucagone appartiene alla famiglia degli ormoni secreti.
Funzione del glucagone
Il glucagone generalmente aumenta la concentrazione di glucosio nel sangue promuovendo la gluconeogenesi e la glicogenolisi. Il glucagone diminuisce anche la sintesi degli acidi grassi nel tessuto adiposo e nel fegato. Il glucagone promuove la lipolisi in questi tessuti, il che provoca il rilascio di acidi grassi nella circolazione dove possono essere catabolizzati per generare energia in tessuti come il muscolo scheletrico quando necessario.
Il glucosio è immagazzinato nel fegato sotto forma di glicogeno, un polisaccaride che è un glucano (un polimero composto da molecole di glucosio). Le cellule epatiche (epatociti) hanno recettori per il glucagone. Quando il glucagone si lega ai recettori del glucagone, le cellule epatiche convertono il glicogeno in singole molecole di glucosio e le rilasciano nel flusso sanguigno, in un processo noto come glicogenolisi. Quando lo stoccaggio di glucosio diventa esaurito, il glucagone incoraggia quindi il fegato e i reni a sintetizzare ulteriore glucosio tramite gluconeogenesi. Il glucagone arresta la glicolisi nel fegato, facendo sì che gli intermedi glicolitici vengano orientati verso la gluconeogenesi.
Il glucagone regola anche il tasso di produzione di glucosio attraverso la lipolisi. Il glucagone induce lipolisi negli esseri umani in condizioni di soppressione dell’insulina (come nel diabete mellito di tipo 1).
La produzione di glucagone sembra dipendere dal sistema nervoso centrale attraverso vie ancora da definire. Negli animali invertebrati, è stato riportato che la rimozione dell’eyestalk influisce sulla produzione di glucagone. L’asportazione dell’eyestalk in giovani gamberi produce iperglicemia indotta dal glucagone.
Meccanismo d’azione del glucagone
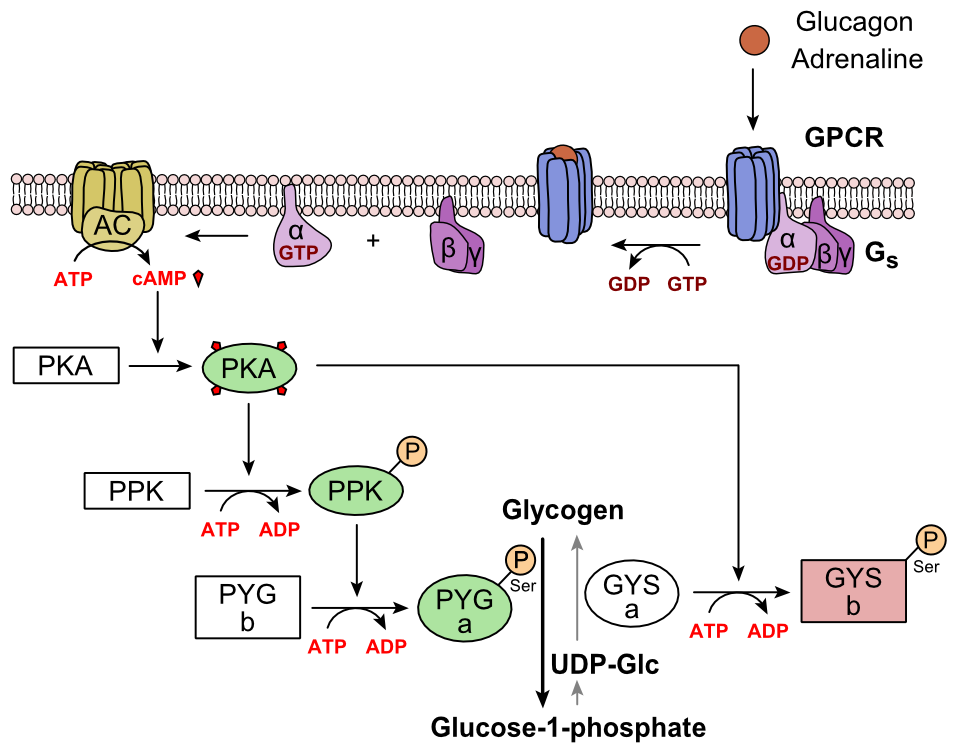
Il glucagone si lega al recettore del glucagone, un recettore accoppiato a proteine G, situato nella membrana plasmatica della cellula. Il cambiamento di conformazione nel recettore attiva le proteine G, una proteina eterotrimerica con subunità α, β e γ. Quando la proteina G interagisce con il recettore, subisce un cambiamento conformazionale che porta alla sostituzione della molecola di GDP che era legata alla subunità α con una molecola di GTP. Questa sostituzione porta al rilascio della subunità α dalle subunità β e γ. La subunità alfa attiva specificamente l’enzima successivo nella cascata, l’adenilato ciclasi.
L’adenilato ciclasi produce adenosina monofosfato ciclico (AMP ciclico o cAMP), che attiva la proteina chinasi A (chinasi dipendente da AMP ciclico). Questa enzima, a sua volta, attiva la chinasi della fosforilasi, che poi fosforila la fosforilasi b del glicogeno (PYG b), convertendola nella forma attiva chiamata fosforilasi a (PYG a). La fosforilasi a è l’enzima responsabile del rilascio di glucosio 1-fosfato dai polimeri di glicogeno.
Un esempio della via sarebbe quando il glucagone si lega a una proteina transmembrana. La proteina transmembrana interagisce con Gɑβ𝛾. Gɑ si separa da Gβ𝛾 e interagisce con la proteina transmembrana adenilato ciclasi. L’adenilato ciclasi catalizza la conversione di ATP in cAMP. Il cAMP si lega alla proteina chinasi A, e il complesso fosforila la chinasi della fosforilasi. La chinasi della fosforilasi fosforilata fosforila la fosforilasi. La fosforilasi fosforilata clips le unità di glucosio dal glicogeno come glucosio 1-fosfato.
Inoltre, il controllo coordinato della glicolisi e della gluconeogenesi nel fegato è regolato dallo stato di fosforilazione degli enzimi che catalizzano la formazione di un potente attivatore della glicolisi chiamato fruttosio 2,6-bisfosfato. L’enzima proteina chinasi A (PKA), stimolato dalla cascata innescata dal glucagone, fosforila anche un singolo residuo di serina della catena polipeptidica bifunzionale contenente entrambi gli enzimi fruttosio 2,6-bisfosfatasi e fosfofruttochinasi-2. Questa fosforilazione covalente innescata dal glucagone attiva la prima e inibisce la seconda. Questo regola la reazione che catalizza il fruttosio 2,6-bisfosfato (un potente attivatore della fosfofruttochinasi-1, l’enzima che è il principale passo regolatorio della glicolisi) rallentando il tasso della sua formazione, inibendo così il flusso della via glicolitica e consentendo alla gluconeogenesi di predominare. Questo processo è reversibile in assenza di glucagone (e quindi, in presenza di insulina).
La stimolazione del glucagone su PKA in modo simile inattiva l’enzima glicolitico piruvato chinasi negli epatociti.
Fisiologia
Produzione di glucagone
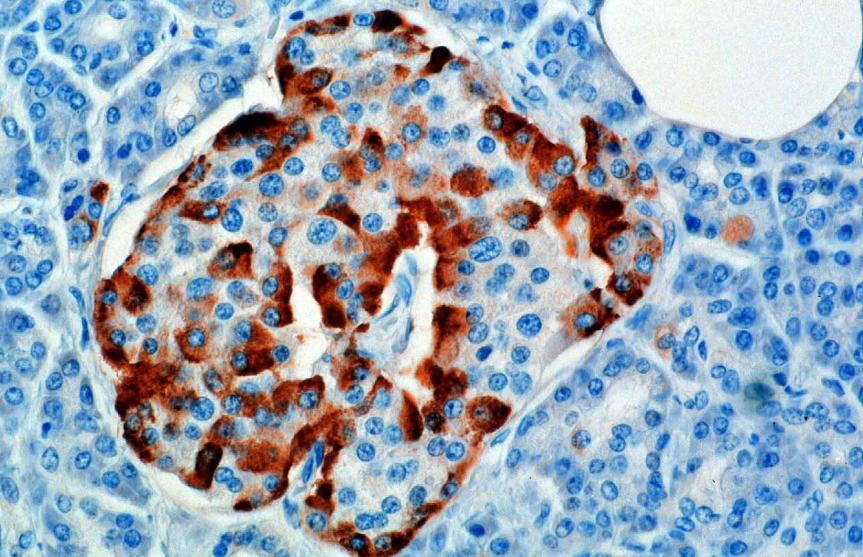
Questo ormone è sintetizzato e secreto dalle cellule alfa (α-cellule) delle isole di Langerhans, che si trovano nella parte endocrina del pancreas. La produzione, che altrimenti è continua, è soppressa/regolata dall’amylin, un ormone peptidico co-secreto con l’insulina dalle cellule β pancreatiche. Quando i livelli plasmatici di glucosio diminuiscono, la successiva riduzione della secrezione di amylin allevia la sua soppressione delle cellule α, permettendo la secrezione di glucagone.
Nei roditori, le cellule alfa si trovano nel margine esterno dell’isola. La struttura dell’isola umana è molto meno segregata e le cellule alfa sono distribuite in tutto l’isola in prossimità delle cellule beta. Il glucagone è prodotto anche dalle cellule alfa nello stomaco.
Ricerche recenti hanno dimostrato che la produzione di glucagone può avvenire anche al di fuori del pancreas, con l’intestino che rappresenta il sito più probabile di sintesi del glucagone extrapancreatico.
Regolazione del glucagone
La secrezione di glucagone è stimolata da:
- Ipoglicemia
- Epinefrina (attraverso i recettori adrenergici β2, α2 e α1)
- Arginina
- Alanina (spesso proveniente dalla transaminazione del piruvato/glutammato derivato dal muscolo)
- Acetilcolina
- Coleschistochinina
- Polipeptide inibitorio gastrico
La secrezione di glucagone è inibita da:
- Somatostatina
- Amylin
- Insulina (attraverso GABA)
- PPARγ/eterodimero del recettore del retinoide X.
- Aumento di acidi grassi liberi e acidi chetonici nel sangue.
- Aumento della produzione di urea
- Peptide simile al glucagone-1
Struttura del glucagone
Il glucagone è un polipeptide composto da 29 aminoacidi. La sua struttura primaria negli esseri umani è: NH2-His-Ser-Gln-Gly-Thr-Phe-Thr-Ser-Asp-Tyr-Ser-Lys-Tyr-Leu-Asp-Ser-Arg-Arg-Ala-Gln-Asp-Phe-Val-Gln-Trp-Leu-Met-Asn-Thr-COOH.
Il polipeptide ha una massa molecolare di 3485 dalton. Il glucagone è un ormone peptidico (non steroideo).
Il glucagone è generato dal taglio del proglucagone da parte della proproteina convertasi 2 nelle cellule alfa delle isole pancreatiche. Nelle cellule L intestinali, il proglucagone viene scisso nei prodotti alternativi glicentina, GLP-1 (un incretina), IP-2 e GLP-2 (promuove la crescita intestinale).
Patologia
Livelli anormalmente elevati di glucagone possono essere causati da tumori pancreatici, come il glucagonomo, i cui sintomi includono eritema necrolitico migrante, riduzione degli aminoacidi e iperglicemia. Può verificarsi da solo o nel contesto della neoplasia endocrina multipla di tipo 1.
Il glucagone elevato è il principale contributore all’acidosi chetonica iperglicemica nel diabete di tipo 1 non diagnosticato o mal trattato. Poiché le cellule beta smettono di funzionare, insulina e GABA pancreatico non sono più presenti per sopprimere l’emissione continua di glucagone. Di conseguenza, il glucagone viene rilasciato dalle cellule alfa al massimo, causando una rapida degradazione del glicogeno in glucosio e rapida chetogenesi. È stato scoperto che un sottoinsieme di adulti con diabete di tipo 1 impiega 4 volte più tempo in media per avvicinarsi all’acidosi chetonica quando viene somministrato somatostatina (inibisce la produzione di glucagone) senza insulina. Inibire il glucagone è stata un’idea popolare nel trattamento del diabete, tuttavia, alcuni hanno avvertito che farlo darà origine a un diabete fragile nei pazienti con glucosio nel sangue adeguatamente stabile.
L’assenza di cellule alfa (e quindi di glucagone) è considerata una delle principali influenze nella estrema volatilità del glucosio nel sangue nel contesto di una pancreatotomia totale.